Các nguyên tử ngoài đời thật không hề giống với hình vẽ này
Đây là biểu tượng mà có lẽ chúng ta đã từng gặp qua ít nhất là một lần trong đời, có thể trong các trang sách giáo khoa, các nơi có liên quan tới “khoa học” hoặc trong cả những bộ phim.

Hình vẽ nguyên tử.
Người ta hay gọi đó là “mô hình nguyên tử” nhưng trớ trêu thay, đây lại không phải là hình dạng thật ngoài đời của nguyên tử và người ta đã biết điều đó từ hơn 1 thế kỷ qua. Tuy nhiên, sức ảnh hưởng của biểu tượng trên đã mạnh tới mức nhiều người vẫn còn nghĩ rằng nguyên tử chỉ đơn giản là một hạt nhân và các e quay quanh nó một cách tròn vành vạnh đẹp mắt đến thế.
Hình vẽ mô hình nguyên tử đầu tiên đến từ đâu?
Để biết về biểu tượng mô hình nguyên tử nói trên thì đầu tiên, chúng ta hãy tìm hiểu xem nó đến từ đâu. Cho đơn giản thì có lẽ nên bắt đầu từ những năm 1909 (chứ thật ra nếu truy xa hơn thì còn về tới tận thời Hy Lạp cổ đại), bắt đầu từ lúc nhà vật lý người Anh Joseph John Thomson phát hiện ra electron, còn gọi là các điện tử - những thành phần mang điện âm trong nguyên tử. Khi đó, ông đề xuất rằng các e này đã bị “bắt” nằm trong các mặt cầu đồng nhất của vật chất tích điện dương. Người ta gọi đây là “mô hình bánh nho khô” bởi các nguyên tử nằm trong các vật chất tích điện dương tương tự như nho khô nằm trong bánh pudding.
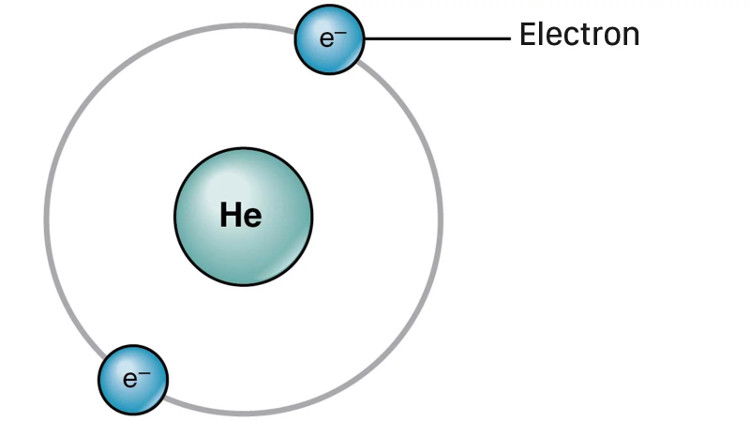
Sau đó, nhà vật lý người New Zealand Ernest Rutherford phát hiện rằng nếu bạn bắn một hạt mang điện dương vào vào các nguyên tử (dưới dạng lá vàng) thì không phải tất đều phản xạ theo kiểu như nằm trong một “khối bánh pudding” khối lượng lớn. Thay vào đó, dù vẫn có phần phản xạ nhưng hầu hết đều bị xuyên qua, cho thấy rằng các electron phải nằm quanh một hạt vật chất mang điện dương có khối lượng nhỏ (hạt nhân), ở giữa là khoảng không. Tới năm 1911, ông mô phỏng lại mô hình đã phát hiện được, trong đó có các e quay quanh một hạt nhân tương tự các hành tinh quay quanh Mặt Trời. Cũng vì lý do này mà người ta còn gọi mô hình nguyên tử kiểu này là mô hình hành tinh nguyên tử.
Tuy nhiên, nếu chuyển động theo mô hình hành tinh nguyên tử thì các e sẽ bị mất năng lượng do có quỹ đạo quanh mặt nhân, khiến chúng va chạm vào hạt nhân. Bởi thế 2 năm sau khi Rutherford đề xuất mô hình hành tinh nguyên tử, nhà vật lý Đan Mạch Niels Bohr. đã giải quyết nhược điểm đó lý thuyết rằng: các e không mãi đi theo quỹ đạo mà thay vào đó, chúng chỉ đi theo quỹ đạo tại những mức năng lượng cụ thể.
Cụ thể, các e có thể nhảy từ mức năng lượng này sang mức năng lượng khác nếu chúng hấp thụ hoặc giải phóng năng lượng, tuy nhiên chúng không bao giờ lệch ra khỏi các mức năng lượng đó. Và mô hình của Bohr cũng đã được dùng để minh họa trong vô số sách giáo khoa trên toàn cầu (các bạn có còn nhớ hình vẽ các e quay quanh hạt nhân trên 2-3 vòng tròn khác nhau). Tuy nhiên, những hình vẽ này cũng không phải là cách các nguyên tử tồn tại ngoài đời.
Mọi chuyện sau đó như thế nào?
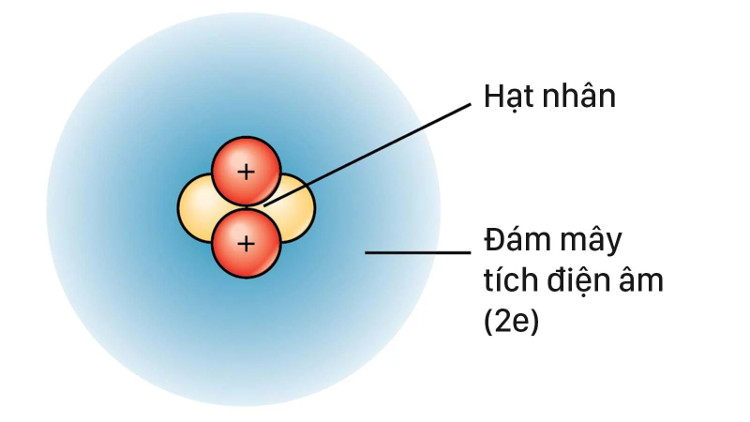
Tới những năm 1920, các nhà vật lý học đã phát hiện rằng vật chất còn có tính chất giống như sóng và quỹ đạo nguyên tử được biểu diễn bằng một hàm toán học mô tả lại trạng thái như sóng điện từ của các e. Một cách dễ hiểu, hàm số này được dùng để tính xác suất tìm thấy e của một nguyên tử tại vị trí bất kỳ nằm trong không gian bao quanh hạt nhân.
Nói cách khác, các e không đi theo những con đường nhất định nhưng sự xuất hiện của chúng trong không gian quanh hạt nhân là có thể xác định. Sau này, các nhà vật lý còn phát hiện ra rằng chúng còn là những hạt lượng tử có thể tồn tại ở nhiều điểm khác nhau cùng lúc. Các e lúc này vẫn nắm giữ các mức năng lượng độc lập nhưng thay vì đi theo đường, mỗi e (với sự hiện diện tại nhiều nơi cùng lúc) có thể được hình dung đám mây. Và đó là lý do có khái niệm là “mô hình đám mây e”.
Cho dễ hình dung thì đó là một vùng không gian quanh hạt nhân và tại bất cứ điểm nào, xác suất tìm thất e là 90%, tức là cứ 100 giây thì có 90 e có mặt tại một điểm nào đó trong đám mây e. Năm 1932, nhà hóa học Robert Mulliken dùng khái niệm “orbital” để diễn tả trạng thái hoạt động của các e trong nguyên tử thay cho từ “orbit” để tránh nhầm lẫn. Và cuối cùng, vẫn không thể nói là mô hình khi xưa của Bohr là không tốt bởi nó vẫn là một cách đơn giản, giúp dễ hình dung một mô hình rất phức tạp. Và kỳ thực, đó cũng là một mô hình cực đẹp mà có lẽ, bất kỳ ai đam mê khoa học đều có ấn tượng không thể phai nhòa về nó.
Khám phá
-

8 nguyên nhân gây ra hội chứng "sương mù não"
-

Khi khoa học viễn tưởng dự đoán chính xác tương lai
-

Cố đô Campuchia suy tàn vì hạn hán
-

Chuyện thú vị về những phát minh
-

Vì sao trái bóng ở mỗi kì World Cup lại khác nhau?
-

Nhà tiên tri Nostradamus dự báo lạnh người cho năm 2023
Khám phá khoa học
-

Top 9 tờ tiền tinh xảo nhất thế giới, trong đó có tiền Việt Nam
-

Độc đáo lễ hội thanh tẩy ngựa ở Tây Ban Nha
-

Suy nghĩ tích cực có thể kéo dài cuộc sống của bạn không?
-

Người thông minh thường bừa bộn, thức khuya và chửi thề nhiều!
-

Lần đầu tiên biết được sự sắp xếp bí ẩn của các tinh thể
-

Vàng 18K mới siêu nhẹ làm từ nhựa thông thường