Câu chuyện về CRISPR: Từ vi khuẩn đến phát kiến vĩ đại của thế kỷ 21
Hồi năm 2012, giáo sư hóa học Jennifer A. Doudna đến từ Đại học Berkeley đã phát hiện ra công cụ dựa trên CRISPR hứa hẹn có thể được dùng để tùy chỉnh bộ mã di truyền DNA một cách chính xác. Cho tới tháng 1/2013, họ đã đạt một bước tiến vĩ đại: Cắt một mẩu DNA từ tế bào người và thay thế nó bằng một đoạn mã di truyền khác.
Cùng lúc đó, một nhóm các nhà nghiên cứu khác đến từ Đại học Harvard và Viện Broad cũng đã độc lập tuyên bố rằng họ đã phát triển thành công phương pháp tương tự. Đây được cho là phát hiện vĩ đại nhất trong ngành sinh học phân tử của thế kỷ 21. Đồng thời, đây cũng là điều sẽ thay đổi hoàn toàn diện mạo của cả nền y học lẫn nông nghiệp của loài người trong tương lai.
Những thành tựu tiếp nối
Kể từ tuyên bố thành công hồi đầu năm 2013 cho đến nay, tuy chỉ trong vỏn vẹn có 2 năm nhưng các nhà nghiên cứu đã tiến hành hàng trăm thí nghiệm xoay quanh bộ công cụ CRISPR. Tất cả đều hướng tới việc nâng trình độ y học và nông nghiệp của con người lên một tầm cao mới, chưa từng có trong lịch sử nhân loại. Một vài nhà khoa học đã tinh chỉnh bộ DNA của chuột nhằm chữa trị các bệnh lý di truyền. Các nhà thực vật học đã sử dụng CRISPR để chỉnh sửa gene của cây trồng, vật nuôi với hy vọng có thể tạo ra một nguồn cung cấp lương thực tốt hơn cho con người. Thậm chí, có nhà nghiên cứu còn dựng lại bộ genê đầy đủ của một con voi ma mút lông xoăn nhằm hồi sinh loài sinh vật cổ đại đã tuyệt chủng này.

Chân dung giáo sư sinh học Jennifer A. Doudna, một trong những người được trao giải thưởng Breakthrough Prize bằng phát hiện ra công cụ tùy chỉnh DNA dựa trên hệ thống CRISPR ở vi sinh vật.
Trong một báo cáo đăng tải trên tạp chí Sinh học sinh sản và nội tiết hồi năm ngoái, nhóm 2 nhà nghiên cứu Motoko Araki và Tetsuya Ishii đến từ Đại học Hokkaido, Nhật Bản còn dự đoán rằng các bác sĩ sẽ có thể dùng CRISPR để chỉnh sửa gene của những phôi thai con người "trong một tương lai rất gần". Các nghiên cứu xoay quanh công cụ CRISPR đã và đang được thực hiện với tốc độ cực kỳ nhanh chóng trên quy mô lớn.
Không chỉ giới học thuật mà ngành công nghiệp dược phẩm cũng nhanh chóng chú ý tới công cụ đầy tiềm năng này. Nhiều hãng dược đã bắt đầu phát triển và thương mại hóa một số loại thuốc dựa vào công cụ CRISPR. Hồi tháng 1 năm nay, tập đoàn dược phẩm khổng lồ Novatis tuyên bố họ đã có thể sử dụng công nghệ CRISPR nhằm phục vụ nghiên cứu liệu pháp điều tri ung thư.
Viện công nghệ Massachusetts (MIT) gọi CRISPR là "phát hiện sinh học vĩ đại nhất thế kỷ". Nhóm nghiên cứu của giáo sư Doudna đã được trao giải thưởng Breakthrough Prize - Quỹ do nhà sáng lập và CEO Facebook Mark Zuckerberg sáng lập nhằm vinh danh những con người đã có cống hiến cho sự phát triển của khoa học. Đi kèm với giải thưởng là số tiền 3 triệu đô la được trao cho nhóm nghiên cứu, gần gấp đôi so với giải thưởng Nobel. Và đây cũng chỉ là 1 trong số rất nhiều giải thưởng danh giá mà nhóm được trao.
Tếp theo, chúng ta sẽ nói về quá trình phát triển 2 công nghệ CRISPR cũng như sơ lược nguyên lý làm việc của chúng. Nhìn chung, chúng ta có thể nói rằng: không có ai thật sự phát minh ra CRISPR. Vì sao vậy? Chắc hẳn các bạn đều nghĩ rằng vậy nhóm đã dùng cách gì để "cắt" và "dán" những đoạn DNA. Trên thực tế, công cụ được sử dụng ở đây chính là "những phân tử có sẵn ngoài tự nhiên": vi khuẩn. Từ hàng triệu năm qua, vi khuẩn đã có thể tự chỉnh sửa bộ DNA của chính bản thân chúng và cho tới hiện tại, chúng vẫn đang ngày đêm thực hiện điều đó tại khắp mọi nơi trên hành tinh này, từ đáy biển sâu thẳm đến ngay trong cơ thể con người.
Vi khuẩn sử dụng khả năng tự biến đổi DNA như một hệ thống miễn dịch tinh vi, cho phép chúng học cách nhận biết kẻ thù. Đây chính là kỹ thuật CRISPR vốn được thực hiện trong thế giới tự nhiên. Dù vậy, từ lâu đây vẫn là một chủ đề bí ẩn đang chờ đợi các nhà khoa học giải đáp. Tuy hiểu biết của chúng ta về thế giới vi sinh vẫn chưa thật sự đầy đủ nhưng rõ ràng, nó cũng đầy hứa hẹn. Nghiên cứu của 2 vị nữ giáo sư chỉ mới phát hiện ra 1 loại CRISPR và vẫn còn nhiều dạng khác của nó đang chờ khám phá ra trong tương lai. Nếu tất cả các bí ẩn về CRISPR đều được giải đáp, con người có thể có thêm một công cụ mới hữu hiệu hơn để chỉnh sửa gen, và thậm chí là dọn đường cho vô vàng những ứng dụng khác trong tương lai.
"Chuỗi mã lặp lại" bí ẩn
Trên thực tế, các nhà khoa học đã khám phá ra CRISPR từ năm 1987 tuy nhiên, họ không ngờ rằng đó lại là một phát hiện mang tính cách mạng và thậm chí, họ không hiểu được họ đã tìm được thứ gì. Vào năm 1987, giáo sư Yoshizumi Ishino và các cộng sự tại Đại học Osaka, Nhật Bản đã công bố một trình tự gene mang tên iap lấy ra từ vi khuẩn E. coli. Khi đó, nhằm tìm hiểu rõ hơn về cách hoạt động của gene, các nhà nghiên cứu đã sắp xếp trình tự của những đoạn mã xung quanh bộ gene ban đầu. Mục tiêu cuối cùng là tìm thấy điểm tiếp xúc với protein nhằm "bật/tắt" iap. Trớ trêu rằng thay vì tìm thấy "công tắc", họ lại phát hiện ra một cái gì đó không thể hiểu được.
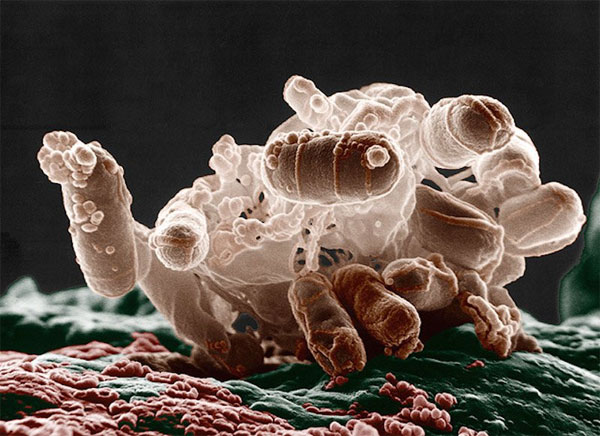
Hình ảnh phóng đại của vi khuẩn E. coli
Nằm gần gen iap có 5 đoạn DNA giống hệt nhau. Như ta đã biết thì DNA được tạo thành từ các "viên gạch" gọi là các Nucleotide (Nu). Trong 5 đoạn DNA giống nhau trên, mỗi đoạn được tạo thành từ 29 Nu. Các chuỗi lặp lại này đã được chia tách ra bởi bộ 32 Nu khác trên chuỗi DNA, gọi là các "khoảng trắng" (spacer). Không giống như các chuỗi lặp lại, mỗi đoạn "khoảng trắng" đều có trình tự duy nhất. Đây là điều mà chưa có nhà sinh học nào phát hiện ra trước đó. Khi các nhà nghiên cứu Nhật Bản công bố kết quả, họ cũng đặt dấu hỏi lớn đối với phát hiện này. Họ viết rằng: "Vai trò sinh học của những khoảng trắng này vẫn chưa được biết tới".
Vào lúc đó, kỹ thuật giải mã DNA vẫn còn khá thô sơ và các nhà nghiên cứu không thể xác định được rằng những trình tự đặc biệt đó chỉ có ở E. coli hay còn có trên loài nào khác hay không. Mãi cho tới những năm 1990, công nghệ tiên tiến đã góp phần đẩy nhanh quá trình giải mã di truyền. Đến cuối thập niên 90s, các nhà sinh học phân tử đã có trong tay những kỹ thuật xác định nhanh trình tự di truyền của mẫu vật. Thậm chí với một thìa nước biển hoặc một mẫu đất, họ có thể nhanh chóng xác định trình tự di truyền của những sinh vật trong mẫu đó. Kỹ thuật này gọi là Metagenomes nhằm thu nhanh vật liệu di truyền trực tiếp từ môi trường. Và khi đó, người ta nhận thấy rằng trình tự sắp xếp do các nhà khoa học Nhật phát hiện trước đó không chỉ có trên E. coli mà còn xuất hiện trên các loài khác.
Đến năm 2002, nhà khoa học Ruud Jansen và các cộng sự tại Đại học Utrecht, Hà Lan đã đặt tên cho "trình tự sắp xếp kiểu lặp đi lặp lại xen khoảng trống" này là CRISPR - Viết tắt của: "Clustered Regularly Interspaced Short Palindromic Repeats". Đồng thời, nhóm của Jansen nhận thấy rằng chuỗi CRISPR luôn đi kèm với một số bộ gen phân bố ở vị trí gần đó. Họ gọi những gene này là Cas gene, những gene có liên qua tới CRISPR và có khả năng mã hóa enzymes cắt DNA. Tuy nhiên, họ vẫn chưa biết được tại sao chúng lại làm như vậy và tại sao chúng lại luôn đi cùng với CRISPR.

Nếu bạn đã ăn sữa chua hoặc phô mai, rất có thể các bạn đã ăn kèm theo các tế bào CRISPR
3 năm sau, 3 nhóm các nhà khoa học đều độc lập tuyên bố rằng họ đã giải đáp được bí ẩn xoay quanh chuỗi CRISPR. Giáo sư Eugene Koonin, người dẫn đầu 1 nhóm nghiên cứu tại Trung tâm công nghệ sinh học quốc gia Hoa Kỳ tại Bethesda đã nghiên cứu về trình tự CRISPR. Koonin kết luận rằng vi khuẩn đã sử dụng CRISPR làm vũ khí chống lại virus. Theo đó, vi khuẩn không hề thụ động trước sự tấn công của virus mà ngược lại, chúng biết cách phòng thủ một cách hiệu quả. Koonin đưa ra giả thuyết rằng vi khuẩn sử dụng enzymes Cas để tóm lấy những đoạn DNA từ virus. Sau đó, chúng sẽ cài những phân đoạn bắt được vào chính trình tự di truyền của chúng. Sau đó, khi bị những đợt virus khác tấn công, vi khuẩn sẽ dùng dãy CRISPR này như một "danh sách mã" để nhận diện kẻ xâm lược.
Dù vậy, vẫn chưa có nhiều nghiên cứu khác được thực hiện nhằm củng cố cho lập luận của Koonin. Mãi cho tới khi nhà sinh vật học phân tử Rodolphe Barrangou bắt đầu thực hiện kiểm chứng. Đối với Barrangou, giả thuyết của Koonin không chỉ là một đề tài nghiên cứu hấp dẫn mà ông còn thực hiện theo đơn đặt hàng của hãng sữa chua nổi tiếng Danisco - một hãng vốn công việc kinh doanh gắn liền với quá trình dùng vi khuẩn để chuyển hóa sữa thành sữa chua.
Trong thử nghiệm kiểm chứng, nhóm của Barrangou đã cho 1 mẫu sữa chua lên men bằng vi khuẩn Streptococcus thermophilus bị nhiễm 2 chuẩn virus. Ban đầu, virus đã giết chết khá nhiều vi khuẩn, nhưng một số vẫn còn sống sót. Khi các vi khuẩn đã hình thành kháng sinh và sinh sản, thế hệ con cháu của chúng đã có khả năng chống lại sự tấn công của 2 loài virus ban đầu. Quan sát các giai đoạn biến đổi bộ mã di truyền của vi khuẩn qua các thế hệ, Barrangou đã phát hiện rằng giả thuyết ban đầu của Koonin là hoàn toàn chính xác.
Hiện tại, Barrangou đang là phó giáo sư tại Đại học bắc Calirona và khi được hỏi về CRISPR, ông hóm hỉnh chia sẻ rằng: "Nếu bạn ăn sữa chua hoặc phô mai, rất có thể bạn đã ăn phải các tế bào mang mã CRISPR".
Cắt và dán
Một khi bí mật ban đầu của CRISPR dần được hé lộ, rất nhiều nhà khoa học khác trong ngành bắt đầu tò mò về nó cũng như những tiềm năng mà nó mở ra. Một trong số đó là giáo sư hóa học Jennifer A. Doudna và một khi bắt đầu nghiên cứu sâu hơn về CRISPR, cô đã khám phá ra những bí mật động trời hơn đang chồng chất bên trong. Trước đó, Doudna đã là vị giáo sư danh tiếng trong ngành, được xem như một chuyên gia về RNA (1 trong 2 đoạn DNA). Về cơ bản, sinh học hiện đại đã xem công việc chính của RNA là "người đưa tin". Trong quá trình phân bào, RNA đóng vai trò sao chép và truyền giữ thông tin duy truyền, là một khuôn mẫu để xây dựng nên protein. Tuy nhiên, giáo sư Doudna và cộng sự đã phát hiện thêm một số chức năng khác của RNA, như làm cảm biến hành động hoặc kiểm soát hoạt động của gene.
Vào năm 2007, tiến sĩ Blake Wiedenheft từ Đại học Montana bắt đầu gia nhập phòng thí nghiệm của giáo sư Doudna với mục đích cùng thực hiện nghiên cứu nguyên lý hoạt động của Cas enzymes. Dù chấp nhận dự án này nhưng ban đầu giáo sư Doudna không nghĩ rằng sẽ phát hiện ra bất cứ giá trị ứng dụng nào của CRISPR. Cô cho biết: "Tất cả đều làm việc để có thêm hiểu biết chứ không hề nhắm tới một mục đích cụ thể nào cả".
Trong quá trình nghiên cứu, nhóm đã xác định cấu trúc của Cas enzymes và cách nó phối hợp hoạt động cùng với các hệ thống di truyền khác. Khi một virus tấn công vi khuẩn, tế bào chủ sẽ tóm lấy một ít vật liệu di truyền của virus, tự cắt chuỗi DNA của chính chúng và chèn đoạn mã di truyền vào các "khoảng trắng". Một khi vùng CRISPR đã được điền DNA của virus vào, nó sẽ trở thành một bộ sưu tập giúp vi khuẩn sẽ nhận dạng virus trong những lần "gặp gỡ" sau đó.
Ở cuộc tấn công tiếp theo, vi khuẩn sẽ dùng đoạn DNA của virus để biến Cas enzymes thành một loại vũ khí dẫn đường chính xác. Khi đó, vi khuẩn sẽ sao chép vật liệu di truyền trong khoảng trắng thành 1 RNA mới. Đoạn RNA này sẽ cùng với Cas enzymes trôi trong tế bào. Nếu nó bắt gặp vật liệu di truyền từ virus đang tấn công trùng khớp với RNA CRISPR, chúng sẽ thít chặt vào nhau. Khi đó, Cas enzymes sẽ cắt DNA của virus ra thành 2 đoạn nhằm ngăn chặn nó sao chép.
Đoạn video mô tả quá trình CRISPR phối hợp cùng với Cas enzymes giúp vi khuẩn phòng chống sự tấn công của virus
Từ phát hiện bất ngờ trên về khả năng của vi khuẩn, nhóm nghiên cứu bắt đầu mở rộng nghiên cứu khả năng phòng thủ các loài vi khuẩn khác trong tự nhiên. Họ phát hiện rằng bằng cách dùng cơ sở dữ liệu và lập trình sẵn, vi khuẩn sẽ dùng các enzymes để tìm ra bất kỳ đoạn DNA nào của virus lạ và ngăn chặn sự tấn công. Quá tuyệt vời! Giáo sư Doudna cho biết: "Một khi chúng tôi đã hiểu được cách vi khuẩn lập trình cho enzymes cắt DNA, chúng tôi có thêm một cách ứng dụng cực kỳ độc đáo. Chúa ơi! Đây thật sự là một công cụ tuyệt vời".
Trên thực tế, đây không phải là lần đầu tiên con người lợi dụng hoạt động của vi khuẩn để phát triển công cụ sinh học. Một số loài vi khuẩn có khả năng tự bảo vệ trước sự tấn công bằng cách sử dụng các phân tử gọi là enzymes giới hạn. Các enzymes này sẽ cắt bất kỳ đoạn DNA nào không sở hữu lá chắn bảo vệ. Theo đó, đầu tiên vi khuẩn sẽ tạo ra các lá chắn để bảo vệ bộ DNA của nó và sau đó, enzymes sẽ làm nhiệm vụ tuần tra. Khi phát hiện bất cứ đoạn DNA nào đang "khỏa thân", nó sẽ xử lý ngay lập tức. Hồi những năm 1970, các nhà sinh vật học phân tử đã phát hiện ra nguyên lý hoạt động kỳ diệu này và khai sinh ra ngành công nghiệp công nghệ sinh học hiện đại như ngày nay.
Sau đó vài thế kỷ, loại kỹ thuật sinh học này đã được cải tiến rất nhiều, nhưng nó vẫn chưa giải quyết được vấn đề khá quan trọng: Các enzymes giới hạn không có khả năng tiến hóa để thực hiện thao tác cắt một cách chính xác. Nghĩa là nó chỉ biết cắt chứ không thể cắt tại điểm mà con người mong muốn. Kết quả là kỹ thuật dùng enzymes giới hạn để cắt chỉ có thể áp dụng trong một số yêu cầu đơn giản. Tuy nhiên, hệ thống CRISPR-Cas mà nhóm của giáo sư Doudna phát triển, có thể giải quyết được điều đó: thực hiện những nhát cắt có kiểm soát một cách vô cùng chính xác.
Từ kỹ thuật cắt chính xác của giáo sư Doudna đến hệ miễn dịch đáp ứng tuyệt vời của vi khuẩn

Từ trái sang phải, CEO Twitter Dick Costolo, giáo sư Emmanuelle Charpentier đến từ Đại học Ulmea, giáo sư hóa học Jennifer A. Doudna đến từ Đại học Berkeley và diễn viên Cameron Diaz tại đêm trao giải thưởng Breakthrough Prize tại trung tâm nghiên cứu của NASA vào hôm 9/11/2014
Để tạo ra công cụ cắt DNA, nhóm của giáo sư Doudna đã chọn hệ thống CRISPR-Cas từ Streptococcus pyogenes, loại vi khuẩn gây bệnh viêm họng. Đây là hệ thống đã được nghiên cứu kỹ lưỡng trước đây và cũng sở hữu enzymes cắt với tên gọi là Cas9. Tiếp theo, nhóm cung cấp cho Cas9 một đoạn RNA có cùng trình tự với đaonj DNA mà họ muốn cắt. Và thế là đoạn RNA sẽ dẫn đường cho hệ thống CRISPR-Cas đến vị trí cần cắt, "bụp", hoàn tất. Bằng cách này, nhóm có thể cắt bất cứ đoạn gen nào mà họ muốn. Công việc tiếp theo là "khâu" một đoạn mã mới vào khoảng trống tạo sẵn. Nhóm cho biết rằng công cụ này có thể được dùng để thực hiện trên bộ mã duy truyền nào đến từ bất cứ sinh vật nào mà họ muốn.
Một kết quả quan trọng khác của phát hiện lần này là cho thấy một khả năng vô cùng kỳ diệu của vi khuẩn giúp nó ngày càng hoàn thiện lá chắn bảo vệ trước sự tấn công của virus. Đây là điều mà con người chưa được khám phá trước đây và các nhà khoa học gọi nó là cơ chế miễn dịch đáp ứng. Chúng ta cũng có cơ chế miễn dịch bẩm sinh và đồng thời, chúng ta cũng sở hữu một hệ thống cao cấp hơn là miễn dịch đáp ứng nhằm chống lại những mầm bệnh bằng cách học tập về chúng.
Hệ thống này được tổ chức tại một số tế bào miễn dịch đặc biệt. Các tế bào này sẽ nuốt chửng tác nhân gây bệnh, sau đó nhả ra các mảnh vỡ của chúng, được gọi là những kháng nguyên và gởi tới những tế bào miễn dịch khác. Khi tế bào miễn dịch bình thường nhận được kháng nguyên, nó sẽ nhân đôi tế bào và tạo nên nhiều tế bào con, ngẫu nhiên có chứa sẵn kháng nguyên. Chu trình này tạo nên một đội quân tế bào miễn dịch có thể nhanh chóng nhận diện và tiêu diệt các mầm bệnh một cách chính xác. Có thể ban đầu, hệ thống miễn dịch phải mất một khoảng thời gian nhất định để thích ứng và xác định nhân tố gây bệnh. Nhưng một khi đã hoàn tất, "ký ức" này sẽ được lưu trữ vĩnh viễn.
Đối với vi khuẩn, chúng cũng sở hữu kiểu miễn dich đáp ứng này và thậm chí là còn tối ưu hơn. Tối ưu hơn con người ở điểm nào? Xin thưa đó là những "bài học" về danh sách tác nhân gây bệnh có thể được truyền trực tiếp qua các thế hệ. Con người không thể truyền các gene trong kháng thể xuống trứng hoặc tinh trùng để dọn đường sẵn cho con cái của họ. Công việc này chỉ thực hiện được bởi các tế bào miễn dịch trong quá trình con người phát triển. Kết quả là trẻ sơ sinh phải bắt đầu học những tác nhân gây bệnh lại từ đầu trong suốt cuộc đời.
Nhưng đối với CRISPR thì mọi chuyện trở nên dễ dàng hơn. Một phần do vi khuẩn là sinh vật đơn bào, DNA của chúng được tiến hóa để chống lại virus và chính bộ DNA này sẽ truyền lại trực tiếp cho thế hệ sau qua phân bào. Nói cách khác, thế hệ sau sẽ tự thừa hưởng những kinh nghiệm của thế hệ trước mà không cần học lại. Vậy sẽ ra sao nếu khả năng này được trang bị cho con người?
Những hứa hẹn xen lẫn hoài nghi về CRISPR trong tương lai
Ảnh minh họa
Tiến sĩ Konstantin Severinov hiện đang công tác tại Đại học Rutgers và Viện khoa học công nghệ Skolkovo, Nga cho rằng những ứng dụng đầy hứa hẹn của công cụ CRISPR có thể sẽ trở thành hiện thực nhưng hiện tại vẫn còn quá nhiều điều cần phải khám phá thêm. Mặt khác, ông cho rằng: "Chức năng miễn dịch đáp ứng của CRISPR chỉ là một cách khoa trương và đánh trống lảng". Ông lập luận rằng nếu cơ chế này giúp vi khuẩn di truyền trực tiếp kiến thức về kẻ thù virus cho các thế hệ sau thì qua hàng nghìn năm qua, cơ sở dữ liệu là vô cùng lớn. Mặt khác, có nhiều loại virus đã tuyệt chủng từ rất lâu về trước, vậy vi khuẩn sẽ làm vì với chúng. Đó là một trong những bí ẩn cần phải giải quyết trong tương lai.
Tuy nhiên, tiến sĩ Severinov vẫn lạc quan cho rằng: "CRISPR là một hệ thống khá linh hoạt có thể được áp dụng trong nhiều tình huống khác nhau. Nhưng cần chú ý rằng sự cân bằng của hệ thống này có thể có sự khác nhau giữa các loài". Nếu các nhà khoa học có thể hiểu biết sâu hơn về cách CRISPR hoạt động trong tự nhiên, họ có thể tạo thêm nhiều kỹ thuật đột phá khác trong tương lai.
Điển hình như cách tùy chỉnh DNA do nhóm của giáo sư Doudna phát triển dựa vào hệ thống CRISPR. Họ đã tinh chỉnh một hệ thống CRISPR-Cas từ loài vi khuẩn là Streptococcus pyogenes và cho thực hiện quá trình cắt chính xác, ghép gen khác tạo nên chuỗi DNA hoàn toàn mới. Một nhóm các nhà nghiên cứu khác đến từ Đại học Cambridge và MIT cũng đã thực hiện thành công điều tương tự nhưng thay bằng hệ thống CRISPR-Cas lấy từ loài vi khuẩn khác là Staphylococcus aureus. Hồi tháng 1 vừa qua, các nhà khoa học tại Editas cũng thực hiện điều tương tự bằng hệ thống Cas9 của Streptococcus pyogenes.
Dù còn nhiều nhóm nghiên cứu khác đang thực hiện hàng loạt các thử nghiệm khác nhau, nhưng họ vẫn đang "bơi trong một đại dương" của các chủng loại CRISPR. Tựu chung, tất cả những nghiên cứu trên đều nhằm một mục đích chung là xác định phương thức hoạt động của CRISPR ngoài tự nhiên và bắt chước nó. Một khi điều này được thực hiện thành công, cuộc sống của con người trong tương lai sẽ biến đổi một cách hoàn toàn ngoạn mục. Từ một nền nông nghiệp mới đến những ứng dụng y học hết sức hữu dụng như công cụ chẩn đoán, hoặc biện pháp chữa trị ung thư,…
Tất cả đều là một tương lai đầy hứa hẹn đã khởi đi từ hôm nay bằng sự phát hiện ra CRISPR. Quả thật: CRISPR là phát kiến sinh học vĩ đại nhất thế kỷ 21.
Sự kiện
-
Phát hiện hai lỗ đen gần Trái đất nhất, thuộc loại chưa từng thấy
-

Nam Cực và Bắc Cực khác nhau như thế nào?
-

Những thực phẩm giúp tăng cường hệ miễn dịch
-

Thomas Edison & những phát minh vĩ đại
-
Sốc với "quái vật" hồi sinh sau khi bị ăn thịt, thản nhiên giao phối, đẻ con
-

Dùng AI mô phỏng các quốc gia vào năm 5000
Câu chuyện khoa học
-

Nơi các bé trai biến mất
-

Nhật từng từ chối đề nghị giúp giải quyết sự cố hạt nhân của Mỹ
-

Chuyện những nhà sáng chế nông dân Quảng Trị
-

Cha đẻ của máy hát karaoke lại là người đánh trống mù nhạc lý, bỏ lỡ hàng trăm triệu USD vì "quên" đăng ký bản quyền
-

Bé gái sống sót kỳ diệu sau khi bị sét đánh
-

Những phụ nữ thay đổi nền y học thế giới