Giấc ngủ ngắn cho đồng hồ sinh học
Chúng ta có thể chợp mắt một lúc để điều chỉnh sự tuần hoàn của giấc ngủ, nhưng tế bào của chúng ta có hệ thống tỉ mỉ và tinh tế hơn nhiều. Con người, giống như hầu hết các sinh vật khác, có nhịp điệu 24 giờ được điều khiển bởi đồng hồ phân tử hết sức chính xác chạy tích tắc bên trong mỗi tế bào.
Sau nhiều thập kỷ nghiên cứu, các nhà khoa học vẫn đang tìm cách nhận biết cơ cấu hoạt động của đồng hồ sinh học và đặt các bánh răng phân tử của cỗ máy đó vào đúng vị trí. Nghiên cứu mới do các nhà khoa học thuộc đại học Rockefeller thực hiện cho thấy cơ chế tương tác của hai trong số các phân tử có tính chất quyết định để có thể điều khiển chu trình của đồng hồ sinh học, cũng như cơ chế rối loại của vòng quay sinh lý, từ đó có thể nhận biết nguyên nhân của các chứng rối loạn giấc ngủ mang tính di truyền.
Michael Young, Richard và Jeanne Fisher, giáo sư đồng thời là người đứng đầu phòng thí nghiệm di truyền học, cùng các đồng nghiệp đã cho thấy đồng hồ sinh học mang một công tắc bật - tắt do enzyme điều khiển gọi là doubletime. Doubletime, hay DBT, có cái tên như thế bởi đột biến gen mã hóa enzym khiến đồng hồ sinh học chạy như bay. DBT hoạt động bằng cách gắn một nhóm phốtphat vào các protein, quá trình này gọi là phosphorylation (phốtphat hóa). Chuỗi protein mà DBT phốtphat hóa, được gọi là period (chu kỳ) hay PER, có vai trò quan trọng trong việc điều chỉnh thời gian của đồng hồ sinh học, điều khiển hoạt động của các gen khác trong chu trình tắt và bật 24 giờ liên tục. Các nhà khoa học hiểu rõ vai trò DBT trong việc điểu khiển protein period bằng cách gắn một nhóm phốtphát vào protein này. Tuy nhiên nghiên cứu mới của Young cho thấy DBT có thể kìm nén hoặc hoạt hóa PER bắng cách gắn nhóm phốtphat vào những vị trí khác nhau.
 |
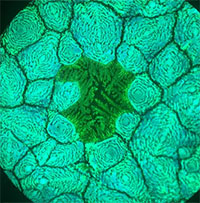
| Nghiên cứu mới phát hiện cơ chế rối loạn vòng quay của đồng hồ sinh học trong cơ thể nhằm nhận biết nguyên nhân của các chứng rối loạn giấc ngủ mang tính di truyền. (Ảnh: iStockphoto/Phil Date) |
Việc phát hiện rằng DBT không chỉ có một mà đến hai mục tiêu phốtphat hóa trên PER cho thấy enzim này hoạt động như một công tắc. Young cho biết: “Đó là công tắc phốtphát hóa do doubletime điều khiển có vai trò xác định liệu protein có hoạt động hay không”. Trong giai đoạn “tắt”, tế bào khuấy động những protein PER ổn định nhưng không hoạt động, tình trạng này do nhóm phốtphat ở vị trí mục tiêu thứ nhất tạo ra. Trong giai đoạn “bật”, nhóm phốtphat tại vị trí mục tiêu thứ hai hoạt hóa protein nhưng làm nó mất ổn định vì vậy PER chỉ hoạt động trong vài giờ đồng hồ. Sau đó, tế bào lại tích lũy các protein không hoạt động và vòng tuần hoàn mới bắt đầu.
Young và các đồng nghiệp cũng phát hiện thấy đột biến ở DBT đẩy nhanh đồng hồ sinh học: Các protein period lỡ mục tiêu phosphorylation thứ nhất có tác dụng kìm nén phosphorylation khi công tắc “bật”. Chính vì vậy, protein period không hoàn toàn ổn định. Young cho biết: “Nếu bạn không phốtphat hóa mục tiêu thứ nhất, bạn sẽ tự động bỏ qua để đến mục tiêu thứ hai, phốtphat hóa mục tiêu thứ hai một cách vội vã và tạo ra một sự kìm hãm thái quá. Khi hiện tượng kìm hãm hoạt động quá sớm và biến mất nhanh chóng, bạn gặp phải hiện tượng “chu kỳ ngắn”. Nói một cách khác, bạn thức dậy quá sớm và đi ngủ cũng quá sớm, hay bạn có đồng hồ sinh học chạy nhanh.
Các nhà khoa học vẫn luôn nghiên cứu những gia đình với thành viên mắc phải phiên bản di truyền của hiện tượng “chu kỳ ngắn” này, gọi là FASPS (Hội chứng ngủ sớm trong gia đình). Những người mắc hội chứng này thức dậy trước bình minh và đi ngủ trước khi mặt trời lặn. Nghiên cứu về một trong những gia đình như thế tại Utah đã cho thấy sự thiếu sót tương tự trong quá trình phosphorylation ở protein period. Các nhà nghiên cứu tin rằng những ảnh hưởng phát hiện được trên ruồi do nhóm nghiên cứu của Young tiết lộ cũng có thể là nguyên nhân khiến đồng hồ sinh học chạy nhanh ở người mắc FASPS. Young cho biết: “Nhiều đặc tính được tìm thấy ở người cũng nhất quán với những gì phát hiện được ở ruồi. Vì vậy nó cũng có thể giúp chúng ta hiểu rõ hội chứng mà con người mắc phải”.
Tham khảo:
Kivimäe et al. Activating PER Repressor through a DBT-Directed Phosphorylation Switch. PLoS Biology, 2008; 6 (7): e183 DOI: 10.1371/journal.pbio.0060183
Khám phá
-

5 thứ cần chuẩn bị khi bão lũ đến
-

Startup Việt Nam chào bán xe bay: Giá từ 2 tỷ, 4 mẫu, đã bay thử 1.000km ở Hà Nội và miền Tây
-

11 loại chim đẹp nhất hành tinh
-

Kinh nghiệm cho hoa mai nở đúng Tết
-
Top 10 ứng dụng thiên văn hay nhất trên Android
-

Thân phận đặc biệt của người đàn ông có khuôn mặt là nguyên mẫu của tượng Nữ thần Tự do
Khám phá khoa học
-

Tìm hiểu kính mắt qua các thời đại
-

Thì ra đây là cách hành lý của bạn được chất đống vào khoang máy bay
-

Sự thật về perovskite - Vật liệu kỳ diệu vượt trội so với silicon hiện nay
-

Trạm điện bỗng phát ra các tia sáng có nhiệt độ lên đến 3.500 độ C, đây là hiện tượng gì?
-

Bí mật về nguyên tố trong lòng Trái đất
-

Mây trên Trái đất có thể dần biến mất!